Standart Altı ve Sahte İlaçlar için Çözümler
14 Mart 2018Dünya İlaç Pazarı Büyüyor, Onkoloji İlaçları Büyük Paya Sahip Olacak!
27 Nisan 20182020’ye kadar, serileştirmenin, küresel ilaç tedarikinin % 80’ini kapsaması bekleniyor, ancak dünyanın farklı bölgelerindeki düzenlemelerin birbirinden farklı ve uyumsuz olması, tedarik zincirinin tüm birimleri için (üreticiler, ecza depoları, eczaneler, hastaneler vb.) için maliyetlerin artması ve sistemin daha karmaşık hale gelmesi geçiş sürecini zorlaştırıyor.
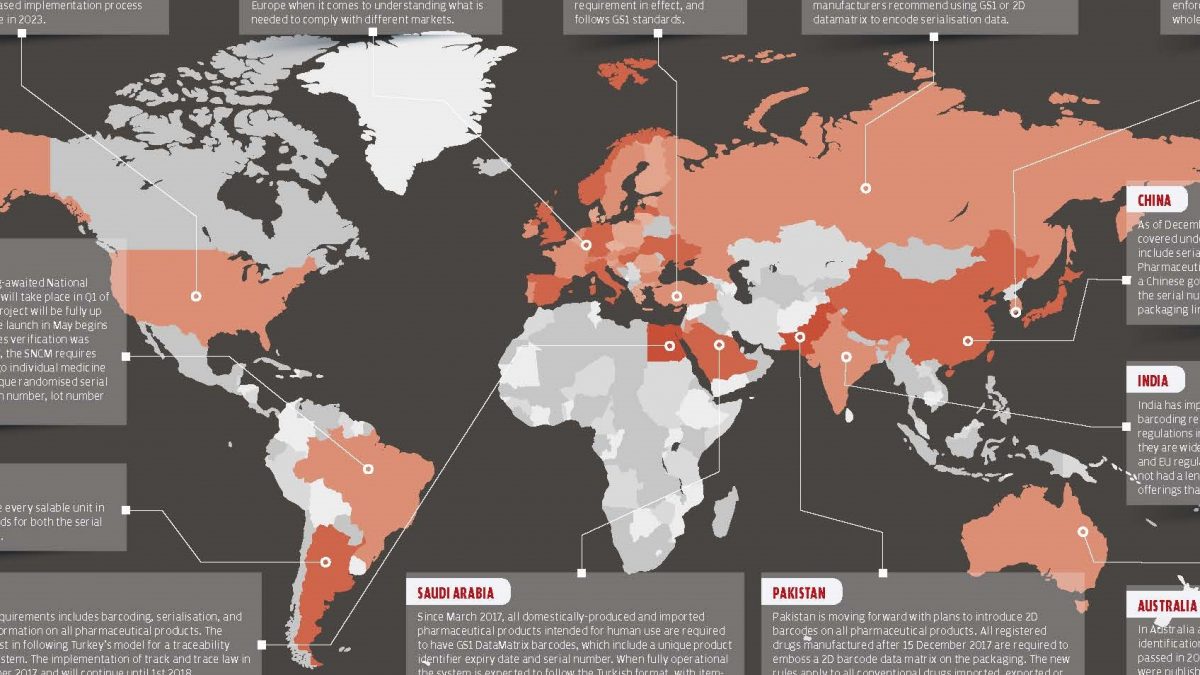
Serileştirme için küresel olarak belirlenen teslim tarihi yaklaştıkça ülkelerin serileştirme uygulamaları da yerleşmeye başlamıştır. Belirtilen ülkelerin serileştirme ve takip edilebilirlik konusunda hangi aşamada olduğunu görmek için Pharmaceutical Serialisation & Traceability Konferansı için düzenlenen 2018 Dünya Serileştirme Haritasını inceleyeceğiz.
Türkiye
Türkiye’de kullanılacak tüm ilaçlar 2011 yılından itibaren her aşamada takip altına alınmıştır. GS1 standartlarına uygun olarak birim bazında ilaç takibi yapılmaktadır. İlaç Takip Sistemi ile hem tedarik zincirinin her aşaması takip edilmekte hem de hastalara güvenli ilaç sağlanmaktadır.
Avrupa Birliği
Serileştirme işleminin genelde 6 ile 9 ay sürdüğü düşünülürse, tedarik zincirinin birer parçası olan üreticiler, ecza depoları vb. işletmeler Sahte İlaç Direktifinde son geçiş tarihi olarak belirtilen 2019 Şubat ayına yetişeceklerini düşünüyorlar. Fakat hala diğer ilaç marketleri ile nasıl entegre edileceği konusunda tartışmalar devam ediyor.
Amerika Birleşik Devleti
Kasım 2017’den bu yana İlaç Tedarik Zinciri Güvenlik Yasası (DSCSA), üreticilerin paketlerini bir ürün tanımlayıcısı, seri numarası, parti numarası ve son kullanma tarihi ile işaretlemelerini şart koşmaktadır. Son teslim tarihinden altı ay önce yapılan bir değerlendirmede, ABD’deki ilaçların sadece yüzde 6,6’sının DSCSA’nın gerekli gördüğü dört veri elemanına sahip olduğu ortaya çıktı. DSCSA’nın 2023’e kadar tam olarak devreye sokmayı planladığı aşamalı bir uygulama süreci bulunmaktadır.
Rusya
Rusya, şu anda aşamalı uygulamaya yönelik olarak çalışmaktadır. 2018’in sonundan itibaren dolaşımda olan insanlara yönelik tüm ilaçlar için bu uygulama ve yasa geçerli olacak. Hazırlanan kanun, standartları açıkça tanımlamıyor ancak sanayi birliği ve üreticiler tüm dünyada kabul göre GS1 standardını veya 2B veri matrisini kullanılmasını tavsiye ediyorlar.
Güney Kore
2016’dan bu yana, Güney Kore’de serileştirme uygulamaları ülkedeki tüm ilaçları kapsamaktadır. 1 Temmuz 2017’den itibaren sadece üreticiler için zorunlu olan serileştirme ecza depoları gibi toptan ilaç satıcıları için de zorunlu hale getirilmiştir.
Çin
Aralık 2015’ten itibaren tüm farmasötik ürünler, Çin’e özel gereksinimleri karşılayacak şekilde serileştirme ve devlet raporlaması kapsamına alınmıştır. İlaç şirketleri üretilen ilaçların tümünü devletin sahip olduğu bir sisteme girmek zorunda aksi takdirde seri numaraları sisteme girilmeyen ilaçların ilaç piyasasına yasal yollardan girmesi mümkün olmamaktadır.
Hindistan
Hindistan, aşamalı serileştirme ve barkodlama gerekliliklerini uygulamaya koymuştur fakat Hindistan’daki serileştirme düzenlemeleri bölgesel olarak uygulandığından, ABD ve AB yönetmeliklerinin getirdiği gereksinimlerin tamamını karşılamamaktadır. Hindistan’daki yazılım endüstrisi, tüm yasal gereksinimleri karşılayabilecek yazılımlar üretmek için yeterince uzun bir zaman aralığına sahip değil.
Avustralya
Avustralya’da tüm ilaçlar için yeni bir barkod tanımlama düzenlemesine 2016 yılında geçildi. Eylül 2016’da, Avustralya pazarı için tüm ilaçlar için geliştirilmiş etiketleme gerektiren yeni düzenlemeler yayınlandı fakat bu düzenlemeler serileştirme için geçerli değil. Kanun, 2020 yılı Eylül ayında yürürlüğe girecek ve tüm tedarik zinciri öğeleri için zorunlu hale gelecektir.
Suudi Arabistan
Mart 2017’den itibaren, insan kullanımına yönelik üretilen tüm yerli ve yabancı ilaçların, benzersiz bir ürün tanımlayıcısı, son kullanma tarihi ve seri numarası içeren GS1 DataMatrix barkodlarına sahip olması zorunlu hale getirilmiştir. Tam olarak uygulamaya alındığında Türkiye’de kullanılan İlaç Takip Sisteminin formatında çalışan birim bazında takip yapan bir sistem olması bekleniyor. Suudi Arabistan’da kullanılacak sistemi de Türkiye’de İlaç Takip Sistemini tasarlayan ve hayata geçiren TİGA Bilgi Teknolojileri A.Ş. gerçekleştirecektir.
Mısır
Mısır’da, tüm farmasötik ürünler barkodlama, serileştirme ve bilgilerin devlet tarafından raporlanması işlemlerine tabiidir. Mısır, izlenebilirlik ve uyumluluk raporlama sistemi için Türkiye’nin modelini takip etmektedir. İzleme ve takip kanunu 1 Eylül 2017’de uygulanmaya başlamıştır ve 1 Ocak 2018’e kadar devam etmiştir.
Brezilya
Brezilya’da uzun zamandır beklenen Ulusal Uyuşturucu Kontrol Sistemi (SNCM) için pilot uygulama, 2018’in ilk çeyreğinde gerçekleşecektir. Proje için oluşturulan veri tabanı, 8 yıllık ilaç doğrulanmasının ardından Mayıs 2018’de tam olarak çalışmaya başlayacaktır. SNCM, tek bir ilaç paketine tek bir randomize seri numarası, ulusal kayıt numarası, parti numarası ve son kullanma tarihi içeren 2B barkod ekleme şartını getirmiştir.
*https://pharmaserialisation.iqpc.co.uk/